Les tumeurs de Pancoast-Tobias ou tumeurs de l’apex entraînent un syndrome clinique caractéristique, le syndrome de Pancoast-Tobias qui a été d’abord décrit par Edwin Hare, en 1838. Elles sont définies comme étant des tumeurs d’un sommet pulmonaire envahissant la paroi du détroit supérieur du thorax. Cette topographie aux confins thoraciques du cou et du membre supérieur explique la richesse et la variété de leur présentation clinique. En 1924, Henry Pancoast, radiologue, a appelé cette tumeur localisée à l’apex pulmonaire et associée à des plaintes typiques, «la tumeur du sommet thoracique».
1. Définition clinique
Le Syndrome de Pancoast-Tobias marque une atteinte du tronc primaire inférieur, associant des signes d’atteinte de C8 et un syndrome de Claude-Bernard-Horner (par atteinte du ganglion sympathique cervical inférieur). Le syndrome de Pancoast-Tobias est classiquement défini par la combinaison (1) d’une douleur de l’épaule et du bras avec éventuellement une parésie et un engourdissement dans le territoire de la huitième racine cervicale et de la première racine thoracique + (2) une amyotrophie des muscles intrinsèques de la main + (3) un syndrome de Claude-Bernard-Horner et +/- (4) une lyse costale ou du corps vertébral sur la radiographie, qui montre aussi une opacité de l’apex pulmonaire.
2. Rappel anatomique
La complexité de l’anatomie du défilé cervico-thoracique n’en permet pas une description exhaustive et seules seront envisagées les structures anatomiques les plus susceptibles d’être envahies par les tumeurs de l’apex.
2.1. Rapport anatomique de l’apex pulmonaire
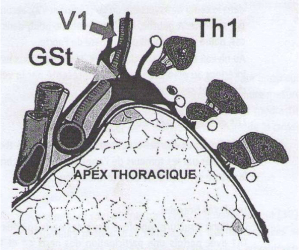
L’apex du poumon correspond à une partie du poumon situé au dessus de l’orifice supérieur du thorax et qui est recouvert par le dôme pleural, constitué de la profondeur vers la périphérie par: (1) La plèvre viscérale adhérente au poumon, (2) La plèvre pariétale qui adhère au périoste de la première côte en arrière et à la gaine vasculaire de l’artère sous-clavière en avant, (3) Le fascia endothoracique qui adhère à la face supérieure de la plèvre pariétale et qui constitue un plan de clivage dénommé plan extrapleural; et comprend 3 versants: (1) un versant antérieur incliné en pente douce en bas et en avant, (2) un versant postérieur plus abrupt, oblique en bas et en arrière, et (3) un versant interne, vertical (figure 1).
L’orifice supérieur du thorax est limité : (1) en haut par le bord supérieur de la première côte, qui est d’orientation oblique, d’environ 45° par rapport à l’horizontal, (2) en arrière par le corps vertébral de T1 (première vertèbre thoracique) dont la saillie du corps vertébrale réduit fortement le diamètre antéropostérieur de l’orifice supérieur du thorax, et (3) en avant par le bord supérieur du manubrium sternal et l’extrémité interne de la clavicule (figure 2).
L’apex pulmonaire est constitué de 4 environnements : un environnement osseux, un environnement musculaire, un environnement vasculaire, et un environnement nerveux.
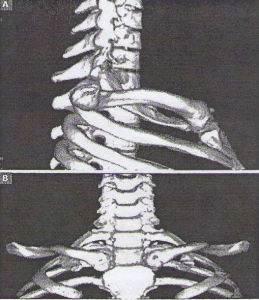
■ L’environnement osseux : Il est essentiellement représenté par la 1ère côte, la clavicule et le rachis. A la partie moyenne de la première côte, il existe une gouttière qui correspond au passage des vaisseaux sous-claviers.
■ L’environnement musculaire : Il constitué par les muscles intercostaux et paroi thoracique postérieure et les muscles scalènes.
Les espaces intercostaux notamment postérieurs sont fréquemment impliqués dans l’extension pariétale des processus expansifs du sommet. A ce titre, ils font partie de son environnement et la connaissance de leurs éléments constitutifs est utile. Les muscles intercostaux constituent trois plans de la profondeur à la superficie: (1) les muscles intercostaux interne s’étendent de l’angle costal postérieur jusqu’à environ 6 cm en dehors du sternum en avant, (2) les muscles intercostaux moyens n’existent que dans la moitié antérieure de l’espace intercostal, de la ligne axillaire moyenne jusqu’au bord du sternum, et (3) les muscles intercostaux externes en occupent les trois quarts postérieurs, de l’articulation costo-transversaire jusqu’à la jonction chondro-costale. Le paquet vasculo-nerveux intercostal constitué de haut en bas par la veine, l’artère et le nerf intercostal est situé dans un environnement graisseux qui en facilite sa reconnaissance en IRM. Les espaces intercostaux postérieurs sont souvent envahis par les tumeurs de l’apex. A ce niveau, seul le muscle intercostal externe est présent.
Le défilé des muscles scalènes constitue un repère anatomique fondamental par son contenu nerveux et vasculaire. Il est très fréquemment envahi par les tumeurs apicales postérieures. Le muscle scalène antérieur constitue un repère anatomique important. Il s’entend des apophyses transverses de C3 à C6, il s’insère sur la première cote, sur le tubercule de Lisfranc. De chaque côté de cette tubérosité et du scalène antérieur s’individualise une gouttière anatomique ; l’une, en arrière, est dénommé défilé des scalènes et permet le passage de l’artère sub-clavière et des nerfs du plexus brachial tandis que l’autre en avant correspond au passage de la veine sub-clavière. Le scalène moyen constitue la limite postérieure du défile des scalènes, il s’insère d’une part sur les gouttières transversaires de C2 à C6 et sur l’apophyse de C7 et d’autre part sur la face supérieure de la première côte, en arrière et en dehors de l’insertion du scalène antérieur. Le scalène postérieur ne rentre pas directement dans l’environnement de l’apex thoracique, il descend des apophyses transverses cervicales jusqu’à la deuxième cote.
■ L’environnement vasculaire de la sortie du thorax : A droite comme à gauche, l’artère sub-clavière décrit une vaste courbe à concavité inférieure sur le versant antérieur du dôme pleural puis passe dans le défilé interscalénique et adopte un trajet oblique en bas et en dehors jusqu’à ,la pince costo-claviculaire ou elle devient l’artère axillaire. Au voisinage du dôme pleural, l’artère sub-clavière donne naissance à de multiples branches collatérales parmi lesquelles l’artère vertébrale est la plus importante. C’est la première collatérale du segment préscalénique de l’artère sub-clavière. Elle se dirige en arrière et en dedans (segment V1), passe au dessus et en avant du ganglion stellaire qu’elle perfore parfois avant de pénétrer dans le canal transversaires de C6 (segment V2) accompagné par sa veine. A gauche, l’artère vertébrale peut, dans 6% des cas naître directement de l’aorte.
Au niveau du creux sus claviculaire, le plan veineux est antéro-inférieur au plan artériel, il est représenté par la veine sub-clavière et ses affluents
■ L’environnement nerveux : Les principaux éléments nerveux du défilé cervico-thoracique concernés par les tumeurs de l’apex sont le plexus brachial et la chaîne sympathique cervico-thoracique.
Le plexus brachial est une structure complexe issue des nerfs spinaux de C5 à T1 avec parfois une participation des nerfs C4 et T2. Ces nerfs vont se diviser puis se rejoindre formant un réseau dans lequel on décrit des troncs et des divisions en cordes. Le plexus brachial est situé à la fois dans la région sus claviculaire et dans le creux axillaire où naissent ses racines terminales mais seule sa partie supérieure, où s’intriquent les différents troncs nerveux, entre en rapport avec le dôme pleural. La partie initiale, radiculaire du plexus est situé dans la gouttière des apophyses transverses puis dans la partie la plus interne du défilé interscalénique. Les racines C5, C6 et C7 émergent à la partie la plus élevée du triangle intercostoscalénique. Les deux racines les plus inférieures, C8 et T1, s’appliquent l’une sur le col de la première côte, l’autre en dedans. Dès leur émergence des trous de conjugaison, elles entrent en rapport étroit avec le dôme pleural. La racine Th1 entre en rapport avec le ganglion stellaire et l’artère vertébrale. Les racines C8 et Th1 fusionnent à l’union du tiers postérieur et des deux tiers antérieur du rebord supérieure de la première cote pour constituer le tronc primaire inférieur. Le plexus brachial émet à tous les niveaux de nombreuses collatérales, ses branches terminales sont toutes destinées à l’innervation du membre supérieur, elles naissent en aval du défilé scalénique, dans le creux axillaire.
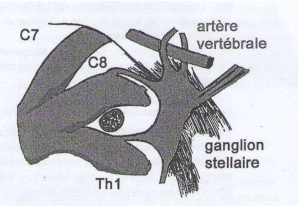
La chaîne sympathique cervico-thoracique est représentée par le ganglion stellaire formé par la fusion du ganglion cervical inférieur et du premier ganglion thoracique. Il est situé au voisinage du rachis sur le versant postérieur du dôme pleural, en avant du col de la première cote, dans la fosse sus rétropleurale de Sebileau ou il entre en rapport avec les racines C8 et T1 expliquant la fréquence de leur atteinte concomitante dans le développement des tumeurs de l’apex. Le ganglion stellaire est recouvert en haut et en avant par l’artère vertébrale qui se coude au dessus de lui ou le perfore pour gagner le canal transversaires de C6 (figure 3). Il émet des branches afférentes vers les racines C6, C7, T1 du plexus brachial et des rameaux qui vont constituer le nerf vertébral qui s’accole à l’artère du même nom.
3. Physiopathologie
Le Syndrome de Pancoast-Tobias est le plus souvent secondaire à une lésion d’origine tumorale au niveau de l’apex pulmonaire, c’est-à-dire des tumeurs malignes ou bénignes envahissant la partie basse du plexus brachial, les vaisseaux sous-claviers, les corps vertébraux, la plèvre pariétale, les côtes apicales ou le ganglion stellaire. La symptomatologie clinique est la traduction d’une compression ou d’une infiltration des structures de voisinage de l’apex pulmonaire. Les cellules cancéreuses envahissent les nerfs qui constituent le plexus brachial, c’est-à-dire l’ensemble des nerfs allant dans le bras, provoquant d’intenses douleurs de l’épaule et du bord interne du bras, ainsi qu’une atrophie des muscles de la main. Ce syndrome s’associe assez fréquemment avec celui de Claude Bernard-Horner.
4. Diagnostic
4.1. Clinique
La tumeur se développe à proximité des racines nerveuses de C8, Th1 et Th2 (nerf cubital), de la chaîne sympathique et du ganglion stellaire.
■ Globalement, les tumeurs se présentent au diagnostic avec un syndrome de Pancoast-Tobias complet et peuvent apparaître dans trois principaux territoires dont les symptômes y sont rattachés : antérieur, dans lequel elles envahissent les vaisseaux sanguins importants comme l’artère sous clavière ; intermédiaire dans lequel elles atteignent surtout le plexus brachial ; et postérieur, dans lequel elles touchent le ganglion stellaire et les corps vertébraux, ce qui a été le cas de nos patients. En cas d’invasion du plexus brachial, les patients présentent souvent une douleur débutant dans l’épaule et la région scapulaire et s’étendant ensuite sur le versant ulnaire du bras (dermatome Th1) et jusqu’à l’auriculaire et à l’annulaire (dermatome C8). Cette douleur peut être très intense et souvent les patients sont d’abord adressés au neurologue, au rhumatologue ou à l’orthopédiste. Du fait de l’augmentation de la pression sur les racines nerveuses, l’atrophie musculaire avec un aspect ulnaire de la main et la perte du réflexe tricipital peuvent se produire.
En raison des symptômes aspécifiques, le délai entre le début des symptômes et le diagnostic est environ 6 à 10 mois. Ceci est dû probablement à la sourdité des symptômes. Les symptômes pulmonaires spécifiques comme la toux, la dyspnée, les hémoptysies sont absents au stade initial de la maladie en raison de la localisation périphérique de la tumeur. La symptomatologie clinique est dominée par les névralgies cervico-brachiales, la dyspnée d’effort et l’altération de l’état général. Chez environ 20% des patients, l’envahissement de la chaine sympathique et du ganglion stellaire provoque le syndrome de Claude-Bernard-Horner (ptosis, myosis et enophtalmie ipsilateraux). Un diagnostic histopathologique est souvent difficile à obtenir par fibroscopie bronchique.
■ La douleur : elle est localisée à l’épaule et dans l’espace inter scapulo-vertébral et peut s’étendre ensuite à la face interne du bras et de l’avant-bras jusqu’aux deux derniers doigts de la main ; elle est habituellement importante, vite insupportable, permanente et résistant aux antalgiques habituels ; le patient a souvent une position antalgique, se soutenant le coude pour la diminuer.
■ Le syndrome de Claude Bernard-Horner : Diagnostiqué sur un myosis, un rétrécissement de la fente palpébrale, et une énophtalmie, il se complète de troubles vaso-moteurs (anhydrose) homolatéraux de la face. Il traduit l’envahissement de la chaîne sympathique et du ganglion stellaire. On peut observer, dans un premier temps, des épisodes de rougeur et d’hyperhydrose dans les mêmes territoires dus à l’irritation de la chaîne sympathique.
■ Des troubles sentivo-moteurs : Ils portent sur la sensibilité du 5ème doigt et la moitié externe du 4ème doigt de la main, et la paralysie de la flexion et de l’opposition des doigts suivie d’une atrophie pouvant aller jusqu’à la « main de singe« .
4.2. Diagnostics différentiels
Le diagnostic différentiel du syndrome de Pancoast Tobias inclut d’autres néoplasmes thoraciques primaires (mésothéliome, lymphome, plasmocytome), les processus infectieux avec les organismes comme actinomyces, staphylococcus et ecchynococcus, les formes neurologiques des syndromes du défilé cervico-thoracique et l’amylose pulmonaire, l’arthrose et la discarthrose pour la douleur cervicale, la périarthrite scapulo-humérale (pouvant conduire à des injections de corticoïdes retard capables de modifier momentanément la symptomatologie et de retarder le diagnostic) pour la douleur de l’épaule ; ainsi qu’avec les douleurs pseudo-angineuses devant l’irradiation à la face interne du bras. Cette large variété d’étiologies rend nécessaire de faire le diagnostic définitif avant de débuter le traitement. Après que le diagnostic d’une tumeur de Pancoast Tobias ait été confirmé, il est important d’en définir le stade de façon approprié pour organiser une prise en charge optimale de la tumeur
4.3. Imageries
Une bonne imagerie est indispensable car l’extension anatomique des lésions est un élément déterminant de la décision thérapeutique.
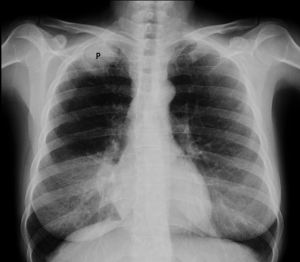
■ La radiographie thoracique : C’est le premier examen habituellement fait en pratique; elle montre une opacité de l’extrême sommet de l’image thoracique et fait partie de la description initiale. Sur une radiographie pulmonaire de face, la tumeur peut apparaître comme une petite masse ou un épaississement pleural de l’apex pulmonaire avec atteinte costale et le possible envahissement d’un corps vertébral, mais la tumeur peut être facilement méconnue sur les incidences habituelles. Les incidences légèrement obliques ou de profil peuvent aider à mieux visualiser les lésions apicales. Il s’agit cependant de ce que l’on pourrait considérer comme la forme la plus achevée d’un complexe comportant de multiples formes clinico-radiologiques. Une étiologie tumorale est la règle, même si des processus inflammatoires, infectieux ou parasitaires ont été incriminés. La tumeur est typiquement d’origine bronchogénique, mais des processus métastatiques ou lymphomateux ont été rapportés (28). La radiographie est cependant parfois faussement rassurante dans d’authentiques syndromes de Pancoast cliniques et il faut savoir demander une TDM.
■ La Tomodensitométrie et l’IRM : Le bilan anatomique d’une tumeur de l’apex doit comprendre l’évaluation la plus précise possible des rapports de la tumeur avec les vaisseaux sous-claviers, le plexus brachial, le rachis dorsal supérieur et les trous de conjugaison, les premières côtes et la paroi thoracique. Ce bilan nécessite une imagerie moderne TDM et/ou IRM mais qui respecte des impératifs techniques : en TDM coupes de 4 à 5mm jointives, reconstruction dans d’autres plans (frontal, sagittal) nécessitant une acquisition spiralée, injection de produit de contraste, visualisation des coupes avec 3 fenêtres (parenchyme, médiastin, os) ; et en en IRM antenne de surface, acquisitions multiplanaires (frontal, sagittal), injection de produit de contraste.
L’IRM a sans doute un potentiel pour différencier le tissu tumoral actif d’une fibrose mais ceci reste à démontrer. Il n’est pas démontré par contre que des nodules infracentimétriques qui sont les seuls invisibles en IRM doivent faire modifier le choix de la technique d’imagerie. La qualité des examens thoraciques en IRM est très dépendante de la machine et de la technique. Les sensibilités et spécificités respectives des 2 techniques ne sont pas bien connues (séries trop courtes, pas de « gold standard » bien défini, faiblesse d’une technique par rapport à l’autre dans les séries comparatives). Très généralement on admet cependant que la TDM est probablement plus performante pour montrer l’atteinte costale et que l’IRM est supérieure pour montrer les rapports avec le plexus brachial et surtout le rachis (trous de conjugaison, atteinte du corps vertébral).
La TDM est faite pour confirmer ou infirmer la présence de la tumeur de l’apex souvent mal visible sur la radiographie simple. Elle guide la ponction. Si elle montre un envahissement évident des vaisseaux sous-claviers et/ou du rachis, la contre-indication opératoire est avérée. Bien souvent elle est insuffisante pour le bilan anatomique et une IRM est donc faite en 2ème intention. L’ensemble du bilan morphologique locorégional (médiastin, extra thoracique) peut donc être fait aussi bien avec la TDM que l’IRM, mais lorsqu’une séquence de radio ou chimiothérapie est effectuée en pré-opératoire il faut réaliser la même technique pour évaluer le résultat et juger de l’opérabilité secondaire.
■ L’examen le plus sensible pour le diagnostic est la ponction percutanée transthoracique par ponction à l’aiguille. La ponction biopsie transpariétale est guidée par l’échographie ou par le scanner. La fibroscopie est habituellement négative. La biopsie trans-thoracique à l’aiguille fine permet souvent d’obtenir le diagnostic. Une médiastinoscopie peut être nécessaire à droite, une thoracotomie antérieure au 2ème espace intercostal à gauche.
■ Anatomo-pathologie : L’histologie montre généralement un carcinome pulmonaire composite à petites et grandes cellules. La littérature est un peu contre versé dans ce contexte car plusieurs études montrent que les cancers pulmonaires non à petites cellules représentent 90-95 % des cas. L’adénocarcinome est la forme histologique la plus commune, suivie par le carcinome épidermoïde et le carcinome à grandes cellules. Le carcinome à petites cellules est rarement associé à ce syndrome.
■ Bilan d’extension : Il doit être complet, comme devant tout cancer, et comprendre, outre un bilan local et locorégional, l’investigation des sites habituels de métastase (foie, os, cerveau) afin de ne pas méconnaître les rares possibilités chirurgicales qui existent.
■ Staging : Le Pancoast est habituellement un T3 par atteinte de contiguïté de la plèvre viscérale et de la paroi thoracique.
■ Facteurs pronostics : la diminution de la douleur après traitement est de bon pronostic, alors que la N2, syndrome de Claude Bernard Horner, déficit moteur,
atteinte vertébrale et des gros vaisseaux sont de mauvais pronostic.
5. Traitement
Le traitement est avant tout celui de la tumeur qui permettra de lever les compressions. Il semble toutefois important de préciser qu’il est souvent synonyme de stade avancé, et que son pronostic est, à ce titre, réservé. Une prise en charge symptomatique est indispensable (traitement de la douleur).
■ Chirurgie : Elle est le plus souvent précédée ou suivie d’une radiothérapie.(12) Il s’agit d’une chirurgie « en bloc » enlevant la tumeur, la paroi thoracique et les structures avoisinantes. L’envahissement massif du plexus brachial et de la région paravertébrale (foramen intervertébral, corps et lames vertébrales), l’atteinte médiastinale, l’envahissement des tissus mous de la base du cou et les métastases à distance sont des contre-indications à la chirurgie.
■ La radiothérapie, seule, lle est soutenue par ceux qui pensent que la tumeur de Pancoast n’est pas différente des autres T3 et T4 pour lesquels une intervention est, le plus souvent, contre-indiquée. Comme pour toute tumeur, quelle que soit la topographie, la probabilité de contrôle tumoral est d’autant plus forte que la dose d’irradiation est élevée. A visée curative, il faut donc prescrire 60 à 70Gy en 6 à 7 semaines. Les protocoles délivrant des doses plus faibles dans des temps plus courts (ex 45Gy en 3 semaines) sont des protocoles palliatifs dont le but est simplement la sédation des symptômes douloureux ou compressifs.
■ L’association radio-chirurgicale : Elle est soutenue par ceux qui font de la tumeur de Pancoast une tumeur particulière avec une propension particulière à une extension locale. En pré-opératoire la dose d’irradiation délivrée peut difficilement dépasser 40 Gy. Au-delà, l’intensité des phénomènes inflammatoires et de sclérose rend le geste chirurgical difficile. L’argument essentiel permettant de justifier une irradiation exclusivement pré-opératoire est la possibilité que donne cette technique d’irradier le lit tumoral enveloppé de parenchyme pulmonaire dont l’exérèse sera faite secondairement. Ceci évite d’irradier le parenchyme pulmonaire résiduel qui se déplacera secondairement vers la cavité opératoire, permettant peut-être de limiter les conséquences fonctionnelles respiratoires. Mais cette dose d’irradiation n’est pas suffisante, à elle seule, pour contrôler la tumeur, y compris d’éventuels résidus tumoraux microscopiques laissés en place par le chirurgien. 2 voire 3 mois après l’intervention et la fin du premier cycle d’irradiation, il sera souvent nécessaire d’ajouter une seconde séquence d’irradiation de 20 à 30Gy afin de porter la dose totale à 60-70Gy. Or, quel que soit le type de tumeur (à 2 ou 3 exceptions près comme la prostate), on sait que toute interruption d’irradiation est responsable d’une baisse significative de la probabilité de contrôle tumoral. Il apparaît donc que ce type d’irradiation « en sandwich » pose problème. La brachythérapie per-opératoire n’a pas fait la preuve de son efficacité.
En post-opératoire, la radiothérapie paraît plus rationnelle. En effet, volume et dose d’irradiation pourront être au mieux adaptés. Elle n’aura lieu qu’en cas de résidu tumoral microscopique ou macroscopique, celui-ci étant repéré par des clips radio-opaques. L’exclusion du médiastin ne sera pas systématique comme en cas d’irradiation pré-opératoire mais dépendra du compte-rendu anatomo-pathologique. La dose sera également adaptée au compte-rendu anatomo-pathologique. 55Gy seront suffisants en cas de résidus microscopiques contre 65 à 70Gy en cas de reliquats macroscopiques. L’inconvénient principal est l’irradiation du parenchyme pulmonaire sain qui s’est déplacé dans le lit tumoral. Elle peut être seule ou associée à une chimiothérapie.
■ La chimiothérapie : Compte tenu de la rareté du syndrome de Pancoast, il n’existe pas de séries traitant spécifiquement de cette tumeur ; mais son comportement sous chimiothérapie ne semble pas être différent de ce que l’on observe avec les autres cancers bronchiques non à petites cellules.
■ Le traitement de confort : Le traitement de la douleur est essentiel dans la prise en charge d’un syndrome de Pancoast. Au-delà des traitements spécifiques du cancer, les antiinflammatoires et les morphiniques sont souvent nécessaires.
Références
- Marcel Garnier et Valery Delamare, Dictionnaire illustré des termes de médecine, Paris, Maloine, 2004, 28e éd., 1046 p. (ISBN 2-224-02784-2), p. 645
- Edwin S. Hare «Tumor involving certain nerves» Letter to London Med Gaz. 1838;1:16-8.
- Henry K. Pancoast «Importance of careful roentgen ray investigations of apical chest tumours» JAMA 1924;83, 1407-11.
- Henry K. Pancoast «Superior pulmonary sulcus tumor: Tumor characterized by pain, Horner’s syndrome, destruction of bone and atrophy of hand muscles» JAMA 1932;99:1391-6.
- Pancoast HK. Superior pulmonary sulcus tumor: tumor characterized by pain, Horner’s syndrome, destruction of bone and atrophy of hand muscles. JAMA 1932; 99:1391–1396.
- Baccialone J, Minvielle F, Zioua T. IRM des tumeurs broncho-pulmonaires de l’apex. Feuillet de radiologie 2006 :323-335.
- Sergio S. Syndrome de Pancoast-Tobias. Pneumologie 2005 : 270
- Chardac WM, MacCallum JD : Pancoast tumor (five-year survival without recurrence of metastases following radical resection and postoperative irradiation). J Thorac Surg 1956; 31: 535-542.
- Heelan RT, Demas BE, Caravelli JF et al: Superior sulcus tumors: CT and MR imaging. Radiology 1989; 170: 637-641.
- Komaki R, Roh J, Cox JD Superior sulcus tumor: Results of irradiation of 36 patients. Cancer 1981; 48: 1563-1568.
- Laissy JP, Soyer P, Sekkal SR, et al. Assessment of vascular involvement with magnetic resonance angiography (MRA) in Pancoast Syndrome. Magn Res Imaging 1995;13: 523-530.
- Dartevelle PG, Chapelier AR, Macchiarini P, et al. Anterior transcervical-thoracic approach for radical resection of lung tumors invading the thoracic inlet. J Thorac Cardiovasc Surg 1993; 105: 1025-1034.
- Ginsberg RJ, Martini N, Zaman M et al.Influence of surgical resection and brachytherapy in the management of superior sulcus tumor. Ann Thorac Surg 1994. 57: 1440-1445.
- Paulson DL. The « superior sulcus » lesion. In : Delarue NC, Eschapasse H eds. International trends in General Thoracic Surgery. Philadelphia : Saunders, 1985: 121-131.
- Binkley JS. Role of surgery and interstitial radon therapy in cancer of the superior sulcus of the lung. Acta Un Int Cancer 1950; 6: 1200-1203.
- Shaw RR, Paulson DL, Kee JL. Treatment of the superior sulcus tumor by irradiation followed by resection. Ann Surg 1961; 154: 229-240.
- Taylor LQ, Williams AJ, Santiago SM. Survival in patients with superior pulmonary sulcus tumors. Respiration 1992; 59: 27-29.
- Neal CR, Amdur MJ, Mendenhall WM et al. Pancoast tumor: Radiation therapy alone versus preoperative radiation therapy and surgery. Int J Radiation Oncology Biol Phys 1991; 21: 651-660.
- Sartori F, Rea F, Calabro F et al. Carcinoma of the superior pulmonary sulcus – Results of irradiation and radical resection. J Thorac Cardiovasc Surg 1992; 104: 679-683.
- Anderson TM, Moy PM, Holmes EC. Factors affecting survival in superior sulcus tumors. J Clin Oncol 1986; 4: 1598-1603.
- Ouattara M, Xavier D,Jean Philippe A. Tumeurs de l’apex pariéto- pulmonaire : une expérience chirurgicale monocentrique de 63 cas. Chir Thor Card-Vasc 2007 ; 11 : 88-97.
- Pitz A, Brutel de la Rivière CCM, Van Swieten HA, Duurkens VAM, Lammers JWJ, Van Den Bosch JMM . Surgical treatment of Pancoast tumours. Eur J Cardiothorac Surg 2004; 26 : 202-208.
- Deibener J, Spaeth D. Syndrome de Pancoast-Tobias révélant un lymphome non hodgkinien pulmonaire primitif. La Rev Med Int 1999 ; 20 : 1028-1030.
- Maggi G, Casadio C, Pischedda F, Giobbe R, Cianci R, Ruffini E, Molinatti M, Mancuso M. Combined radiosurgical treatment of pancoast tumour. Ann Thorac Surg 1994; 57: 198-202.
- Paulson DL, Weed TE, Rian RL. Cervical approach for percutaneous needle biopsy of Pancoast tumours. Ann Thorac Surg 1985 ; 39 : 586-587.
- Bertin F, Guerlin A, Laskar M. Formes cliniques des cancers thoraciques Traitements des tumeurs de Pancoast-Tobias. Rev des Mal Resp 2006 ; 23:164-169.
- Maxfield RA, Aranda CP. The role of fiberoptic bronchoscopy and transbronchial biopsy in the diagnosis of Pancoast’s tumor. NY State J Med 1987; 87: 326-329
- Arcasoy SM, Jett JR. Superior pulmonary sulcus tumors and Pancoast’s syndrome. N Engl J Med 1997; 337:1370-1376.
- Wright CD, Moncure AC, Shephard J, Wilkins, Jr EW, Mathisen DJ, Grillo HC : Superior sulcus lung tumours: results of combined treatment (irradiation and radical resection). J Thorac Cardiovasc Surg 1987 ; 94: 69- 74.
- Abounadi R. Sarcome d’Ewing costal révélé par un syndrome de Pancoast tobias. Rev Mal Resp 2005 ; 22: 83.